การตรวจติดตามฮอร์โมนความเครียดและฮอร์โมนเพศของช้างเอเชียเพศผู้ (Elephas maximus) ในสวนสัตว์เปิดเขาเขียว
Main Article Content
Abstract
Sopittha Donthapho, Chainarong Punkong, Uraiwan Ratchaya, Yollada Taengphukhieo, Kongphob Parunyakul and Chantima Piyapong
รับบทความ: 25 พฤษภาคม 2567; แก้ไขบทความ: 22 กรกฎาคม 2567; ยอมรับตีพิมพ์: 25 กรกฎาคม 2567; ตีพิมพ์ออนไลน์: 27 พฤศจิกายน 2567
บทคัดย่อ
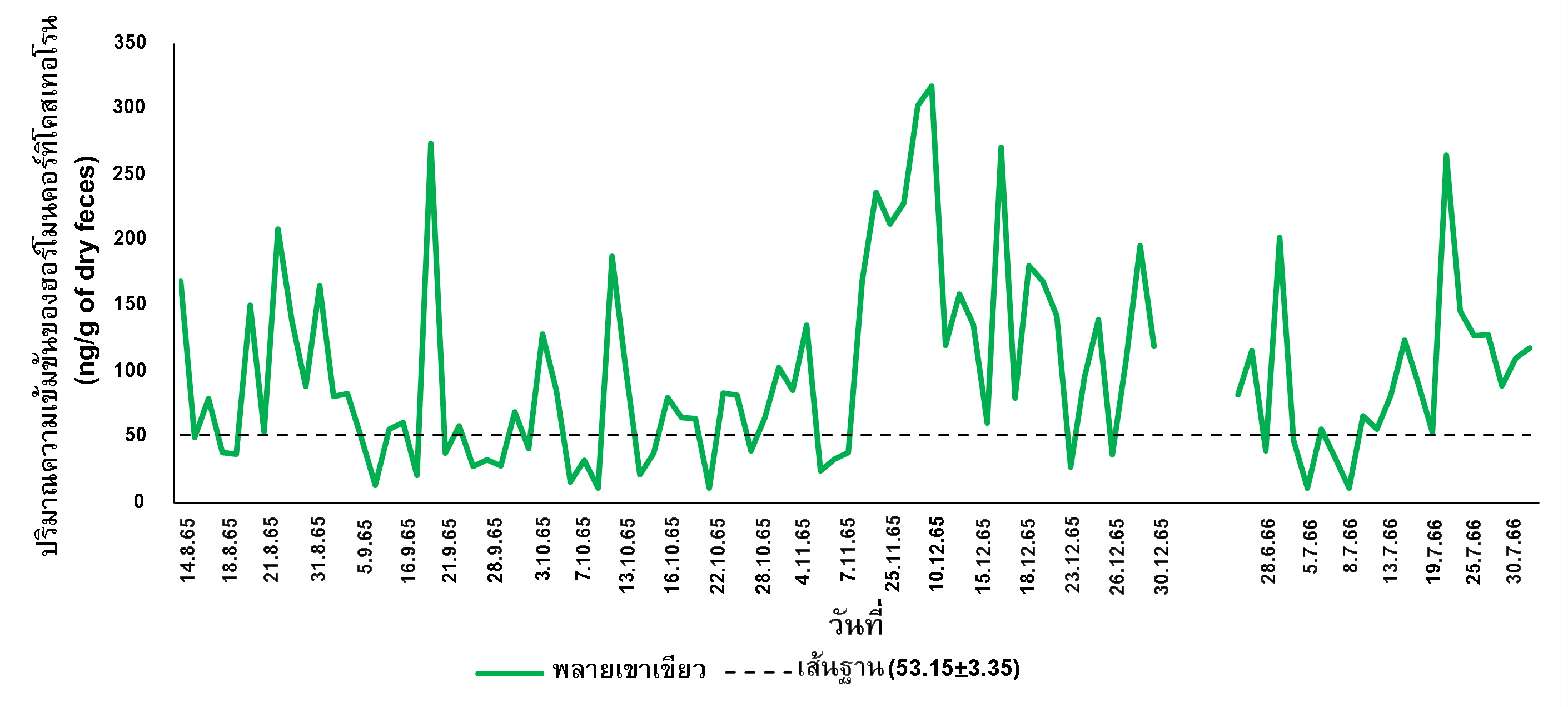
ช้างเอเชีย (Elephas maximus) จัดเป็นสัตว์เลี้ยงลูกด้วยน้ำนมบนบกที่มีขนาดใหญ่ที่สุดในโลกรองจากช้างแอฟริกา ในปัจจุบันสวนสัตว์เปิดเขาเขียวตระหนักถึงสวัสดิภาพของช้างเอเชียในสภาพแวดล้อมแบบทั้งในส่วนแสดงและในคอกเลี้ยง นอกจากนี้ช้างเอเชียเป็นที่นิยมสำหรับนักท่องเที่ยวอย่างจึงถูกสิ่งเร้าจากนักท่องเที่ยวรบกวนซึ่งอาจส่งผลให้ระดับฮอร์โมนความเครียดของช้างเพิ่มสูงขึ้นและอาจส่งผลต่อการทำงานต่อระบบระดับฮอร์โมนเพศที่เหมาะสมต่อการสืบพันธุ์ของช้างเอเชีย วัตถุประสงค์ของการศึกษานี้คือตรวจติดตามการเปลี่ยนแปลงของระดับความเข้มข้นของฮอร์โมนคอร์ทิโคสเทอโรน (corticosterone) และฮอร์โมนเทสโทสเทอโรน (testosterone) และวิเคราะห์ความ สัมพันธ์ของฮอร์โมนทั้งสองชนิดนี้ ในช่วงเดือนสิงหาคม พ.ศ. 2565 ถึงเดือนกรกฎาคม พ.ศ. 2566 โดยการนำมูลของช้างเอเชียเพศผู้จำนวน 4 เชือก มาสกัดฮอร์โมนดังกล่าวและตรวจวิเคราะห์ระดับความเข้มข้นของฮอร์โมนด้วยวิธีการ enzyme immunoassay (EIA) ซึ่งเป็นวิธีการที่ไม่รบกวนตัวสัตว์ (non–invasive method) รวมทั้งใช้สถิติไม่อิงพารามิเตอร์ในการศึกษานี้ ผลการศึกษาพบว่าระดับความเข้มข้นฮอร์โมนคอร์ทิโคสเทอโรนของช้างเอเชียเพศผู้ทั้ง 4 เชือกมีแนวโน้มสูงขึ้นตลอดช่วงระยะการศึกษาโดยสีดอมงคลมีค่าเฉลี่ยสูงสุดเท่ากับ 139.91±7.64 นาโนกรัมต่อหนึ่งกรัมของมูลแห้ง ในขณะที่ระดับความเข้มข้นฮอร์โมนเทสโทสเทอโรนของช้างเอเชียทั้ง 4 เชือกมีช่วงการเปลี่ยนแปลงที่ไม่แน่นอนตลอดช่วงการศึกษา โดยพลายเปี๊ยกมีค่าเฉลี่ยสูงสุดเท่ากับ 254.46±48.22 นาโนกรัมต่อหนึ่งกรัมของมูลแห้ง อย่างไรก็ตามการศึกษาความสัมพันธ์ของฮอร์โมนคอร์ทิโคสเทอโรนและฮอร์โมนเทสโทส-เทอโรนในช้างเอเชียเพศผู้แต่ละเชือกมีความสัมพันธ์กันอย่างมีนัยสำคัญในเชิงบวก (p < 0.01) การศึกษานี้สามารถนำไปใช้เป็นแนวทางในการวางแผนปรับปรุงสภาพแวดล้อมในคอกเลี้ยงและส่วนแสดงของช้างเอเชียในสวนสัตว์เปิดเขาเขียวและสามารถนำเป็นแนวทางในการใช้ประโยชน์ในด้านการส่งเสริมพฤติกรรมของช้างเพื่อสนับสนุนการทำให้ช้างมีสุขภาพและสวัสดิภาพให้ดียิ่งขึ้นในอนาคต
คำสำคัญ: ช้างเอเชีย สวนสัตว์ ฮอร์โมนความเครียด ฮอร์โมนเพศ
Abstract
The Asian elephant (Elephas maximus) is the second largest land mammals in the world after the African elephant. Currently, Khao Kheow Open Zoo has concerned the welfare of the Asian elephants in both their exhibition and captive environments. Also, they are very popular for tourists. Stimuli from tourists could increase the level of stress hormones and may affect the functioning of the sex hormone system, which is unsuitable for achievement of reproduction. The purpose of this study was to monitor changes in corticosterone and testosterone levels and analyze the relationship of these two hormones during August 2022 to July 2023. The fecal samples of four male Asian elephants were extracted by using the enzyme immunoassay (EIA) method, which is a non–invasive method. Nonparametric statistics were used in this study. The results revealed that the corticosterone levels of all male Asian elephants showed high trend throughout experimental period. Elephant named “Mongkol” had the highest level of corticosterone (139.91±7.64 ng/g of dry feces). Meanwhile, the testosterone levels of all male Asian elephants showed uncertain trend throughout experimental period. Elephant named “Piek” had a highest level of testosterone (254.46±48.22 ng/g of dry feces). However, the study of the relationship between the corticosterone and testosterone in each male Asian elephant significantly positively correlated (p < 0.01). This study can be used as a guideline for planning to improve the environment in the Asian elephant’s exhibition and captivity at Khao Kheow Open Zoo and can be used to enrichment for better health and welfare in the future.
Keywords: Asian elephant, Zoo, Stress hormone, Sex hormone
Downloads
Article Details

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
References
Bansiddhi, P., Brown, J. L., Thitaram, C., Punyapornwithaya, V., Somgrid, C., Edwards, K. L., and Nganvongpanit, K. (2018). Changing trends in elephant camp management in northern Thailand and implications for welfare. PeerJ 6: e5996.
Brown, J. L., Bellem, A. C., Fouraker, M., Wildt, D. E. and Roth, T. L. (2002). Comparative analysis of gonadal and adrenal activity in the black and white rhinoceros in North America by non–invasive endocrine monitoring. Zoo Biology 20(6): 463–486.
Brown, J. L., Somerville, M., Riddle, H. S., Keele, M., Duer, C. K. and Freeman, E. W. (2007). Comparative endocrinology of testicular, adrenal, and thyroid function in captive Asian and African elephant bulls. General and Comparative Endocrinology 151(2): 153–162.
Brown, J. L., Walker, S., and Steinman, K. (2005). Endocrine Manual for the Reproductive Assessment of Domestic and Non–Domestic Species. Endocrine Laboratory. Conversation and Research Center Smithsonian’s National Zoological Park, Virginia. Retrieved from https://www.researchgate.net/profile/Danielle-Dillon-2/post/Does-anyone-know-where-I-can-get-an-RIA-kit-to-test-for-progesterone-in-fecal-samples-from-female-elk/attachment/59d6461c79197b80779a127d/AS%3A456343212564480% 401485812108365/download/endo_manual_smithsonian_NZP.pdf, July 17, 2024.
Carmen, B. C. (2012). Serum and Fecal Cortisol Concentrations during the Annual Musth Cycle of Asian Elephant (Elephas maximus) Bulls. Doctoral thesis, Utrecht University.
Cote, J., Clobert, J., Meylan, S., and Fitze, P. S. (2006). Experimental enhancement of corticosterone levels positively affects subsequent male survival. Hormones and Behavior 49(3): 320–327.
Fink, L. B., Mukobi, A., Gruber, L., Reed, C., DeLibero, J., Jackson, S., Neill, S., Walz, J., Sines, C., VanBeek, B., Scalata, C. D., and Wielebnowski, N. (2022). Longitudinal analysis of variability in fecal glucocorticoid metabolite concentrations in three orangutans (Pongo pygmaeus pygmaeus and Pongo pygmaeus abelii) before, during, and after transition from a regular habitat environment to temporary housing in indoor holding facilities. Animals 12(23): 3303.
Ghosal, R., Ganswindt, A., Seshagiri, P. B., and Sukumar, R. (2013). Endocrine correlates of musth in free–ranging asian elephants (Elephas maximus) determined by non–invasive faecal steroid hormone metabolite measurements. PLOS ONE 8(12): e84787.
Glaeser, S. S., Edwards, K. L., Paris, S., Sca-lata, C., Lee, B., Wielebnowski, N., Finnell, S., Somgrid, C., and Brown, J. L. (2022). Characterization of longitudinal testosterone, cortisol, and musth in male Asian elephants (Elephas maximus), effects of aging, and adrenal responses to social changes and health events. Animals 12(10): 1332.
Greco, B. J., Meehan, C. L., Heinsius, J. l., and Mench, J. A. (2017). Why pace? The influence of social, housing, management, life history, and demographic characteristics on locomotor stereotypy in zoo elephants. Applied Animal Behaviour Science 194: 104–111.
IUCN Red List. (2019). Asian Elephants. Retrieved from https://www.iucnredlist.org/species/7140/45818198, September 10, 2023.
Jainudeen, M. R., Katongole, C. B., and Short, R. V. (1972). Plasma testosterone levels in relation to musth and sexual activity in the male Asiatic elephant, Elephas maximus. Journal of Reproduction and Fertility 29(1): 99–103.
Kajaysri, J., and Nokkaew, W. (2014). As-sessment of pregnancy status of Asian elephants (Elephas maximus) by measurement of progestagen and glucocorticoid and their metabolite concentrations in serum and feces, using enzyme immunoassay (EIA). The Journal of Veterinary Medical Science 76(3): 363–368.
Kumar, V., Pradheeps, M., Kokkiligadda, A., Niyogi, R., and Umapathy, G. (2019). Non–invasive assessment of physiological stress in captive Asian elephants. Animal 9: 553.
Leistner, C., and Menke, A. (2020). Hypothalamic–pituitary–adrenal axis and stress. Handbook of Clinical Neurology 175: 55–64.
Millspaugh, J. J., Burke, T., van Dyk, G., Slotow, R., Washburn, B. E., and Woods, R. J. (2007). Stress response of working Africa elephants to transportation and Safari adventures. The Journal of Wildlife Management 71(4): 1257–1260.
Palme, R. (2005). Measuring fecal steroids guidelines for practical application. Annals of the New York Academy of Sciences 1046: 75–80.
Sapolsky, R. M., Romeo, L. M., and Munck, A. U. (2000). How do glucocorticoids influence stress responses? Integrating permissive, suppressive, stimulatory, and preparative actions. Endocrine Reviews 21(1): 55–89.
Squires, J. (2010). Applied Animal Endocrinology. 2nd ed. Massachusetts: CABI North American Office. pp. 247–258.
Xiong, X., Wu, Q., Zhang, L., Gao, S., Li, R., Han, L., Fan, M., Wang, M., Liu, L., Wang, X., Zhang, C., Xin, Y., Li, Z., Huang, C., and Yang, J. (2022). Chronic stress inhibits testosterone synthesis in Leydig cells through mitochondrial damage via Atp5a. Journal of Cellular and Molecular Medicine 26(2): 354–363.
Yon, L., Chen, J., Moran, P., and Lasly, B. (2008). An analysis of the androgens of musth in the Asian bull (Elephas maximus). General and Comparative Endocrinology 155(1): 109–115.